GPRC5B: G-Protein-gekoppelter Rezeptor reguliert Makrophagen-Aktivität
GPRC5B beeinflusst Prostaglandin-Rezeptor und dadurch die Immunabwehr
Einem Team von Wissenschaftlern unter der Leitung von Prof. Dr. Nina Wettschureck vom Max-Planck-Institut für Herz- und Lungenforschung ist es gelungen, die Funktion eines sogenannten Orphan-G-Protein-gekoppelten Rezeptors zu klären. Als Orphan-Rezeptoren bezeichnet man Rezeptoren, deren Funktion bislang noch nicht entschlüsselt werden konnte. Die Bad Nauheimer Forscher haben nun herausgefunden, dass der Orphan-Rezeptor GPRC5B eine entscheidende Rolle bei der Regulierung der Makrophagen-Aktivität spielt. Diese Entdeckung könnte wichtige Impulse für die Entwicklung neuer Therapien gegen Entzündungskrankheiten geben.
Makrophagen: Die Abwehrkämpfer des Immunsystems
Makrophagen sind eine bestimmte Art weißer Blutkörperchen. In der Immunabwehr haben sie als sogenannte Fresszellen die Aufgabe, Krankheitserreger und Körperfremdes zu neutralisieren. Deswegen spielen sie eine zentrale Rolle bei der Abwehr von Krankheitserregern. Ihre Funktion wird durch ein komplexes Zusammenspiel verschiedener Signalmoleküle, sogenannter Entzündungsmediatoren reguliert. Eine Fehlregulation kann zu einer verschlechterten Immunabwehr aber auch zu chronischen Entzündungen führen.
Eines dieser Signalmoleküle ist das Prostaglandin E2. Die Arbeitsgruppe von Prof. Wettschureck konnte nun zeigen, dass ein Rezeptor mit bislang unbekannter Aufgabe die Wirkstärke von Prostaglandin E2 regulieren kann: GPRC5B. Dieser Rezeptor bindet an einen Rezeptor auf der Oberfläche der Makrophagen, den Prostaglandin-Rezeptor EP2. Dies hat einen wesentlichen Einfluss auf dessen Funktionsweise:
„Bindet GPRC5B an den Prostaglandin-Rezeptor EP2, wird die Funktion des EP2 Rezeptors beeinflusst und die Aktivierbarkeit der Makrophagen dadurch gehemmt“, so Wettschureck. „In einem weiteren Experiment hemmten wir die Interaktion zwischen GPRC5B und dem Prostaglandinrezeptor. Daraufhin waren die Makrophagen aktiver und konnten beispielsweise eingedrungene Bakterien besser bekämpfen“,
erklärt Wettschureck. Jeonghyeon Kwon, Erstautorin der Studie, ergänzt:
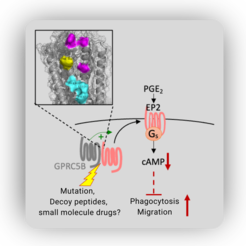
„Wir haben zudem herausgefunden, wie genau die beiden Rezeptoren interagieren. Das ist die Grundlage für einen therapeutischen Ansatz. Wir möchten nun einen Wirkstoff entwickeln, der in dieses regulatorische Zusammenspiel eingreift.“
Die Hoffnung ist, eine Therapie entwickeln zu können, mit der sich akute und chronische Entzündungskrankheiten zielgenauer therapieren lassen.

