Die Rolle von Stammzellen bei der Regeneration und Reparatur von Organen
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für Herz- und Lungenforschung - W. G. Kerckhoff-Institut
I. Entstehung von Zellen mit gewebsspezifischen Eigenschaften aus adulten Stammzellen des Knochenmarks
Üblicherweise unterscheidet man grundlegend zwei verschiedene Arten von Stammzellen. Beiden ist gemein, dass sie zunächst undifferenziert sind, das heißt man kann sie keiner fertigen Gewebszelle zuordnen. Zum einen handelt es sich dabei um so genannte „embryonale Stammzellen“. Sie sind für die Embryonalentwicklung eines Organismus verantwortlich, wobei aus ihnen alle im Körper vorkommenden Gewebstypen entstehen. Dagegen werden bestimmte Zellen im fertig entwickelten Organismus, die ebenfalls die Fähigkeit besitzen, sich in verschiedene Zelltypen zu differenzieren, als „adulte Stammzellen“ bezeichnet. Klassischerweise wurden adulte Stammzellen im Knochenmark untersucht, insbesondere weil ebendort auch die Blutbildung aus Blutstammzellen, den hämatopoietischen Stammzellen, abläuft und für den Nachschub an Blutzellen sorgt. Weniger bekannt ist dagegen, dass adulte Stammzellen auch in nahezu allen Organen zu finden sind. Ihre Funktion dort ist noch nicht völlig entschlüsselt; man geht aber davon aus, dass sie für die Gewebsregeneration beispielsweise in Leber, Herz und Skelettmuskulatur wichtig sind. Es ist denkbar, dass die adulten Stammzellen an Reparaturen nach Verletzungen beteiligt sind (zum Beispiel bei Muskelverletzungen), zum anderen dass der immer wiederkehrende spontane Verlust einzelner Zellen in den Organen durch diese Stammzellen kompensiert wird.
Die Wissenschaftler am MPI für Herz- und Lungenforschung beschäftigen sich mit der noch immer ungeklärten Frage, auf welche Weise diese undifferenzierten Stammzellen die Eigenschaften einer kompletten Gewebszelle erhalten. Prinzipiell sind zwei Mechanismen denkbar: Entweder empfängt die Stammzelle ein Signal, das ihre Weiterentwicklung in Richtung Gewebszelle einleitet. In diesem Falle würde eine Stammzelle sich also in eine Gewebszelle differenzieren. Im Gegensatz dazu könnte es aber auch sein, dass Zellen, die nicht unbedingt die Eigenschaften einer „typischen“ Stammzelle haben müssten, mit einer (kranken) Gewebszelle verschmelzen („fusionieren“). Dadurch könnten sie die gewebstypischen Eigenschaften der ursprünglichen Zelle annehmen und so das jeweilige, geschädigte Gewebe erneuern.
Herstellung zweier Stammzelllinien
Um im Labor der Frage nachgehen zu können, welcher der beiden möglichen Mechanismen nun tatsächlich für die Entwicklung spezialisierter Zellen aus Stammzellen verantwortlich ist, war es zunächst wichtig, eine reine Kultur dieser Zellen anzulegen. Daher wurden aus allen aus dem Knochenmark einer Maus gewonnenen Zellen zwei einzelne Zellen zunächst isoliert und in Kultur genommen und dann zu einer Population genetisch identischer Zellen, einer so genannten Stammzelllinie, herangezogen. Die charakteristischen Eigenschaften der beiden Linien wurden zunächst intensiv analysiert. Mittels immunologischer Verfahren und durch Genanalysen konnten die Wissenschaftler so sehen, dass eine Reihe typischer Zellmarker (bestimmte Proteine, die nur auf einer bestimmten Zelle oder auf wenigen Zelltypen zu finden sind) auf beiden Zelllinien zu finden sind. Allerdings war die Expressionsstärke zweier wichtiger Stammzell-Marker (CD34 und sca-1) unterschiedlich. Dies gab einen Hinweis darauf, dass es nicht die eine Stammzelle zu geben scheint, sondern die Population sich aus verschiedenen, ähnlichen Zellen zusammensetzt. Darüber hinaus konnte festgestellt werden, dass in den adulten Stammzellen auch einige Gene aktiv sind, die eigentlich charakteristisch für embryonale Stammzellen sind, so zum Beispiel Gene mit den Namen Oct3/4, SSEA-1, Rex-1 und B-myb.
Ausbildung von Muskelmarkern nach Stimulierung
Die Muskelzellen in der Skelettmuskulatur und im Herzen sind zwar im Prinzip recht ähnlich aufgebaut, unterscheiden sich aber im Detail. Während der Embryonalentwicklung entscheidet die Anwesenheit bestimmter Proteine darüber, ob aus den undifferenzierten embryonalen Stammzellen eine Skelett- oder eine Herzmuskelzelle entsteht. Da die verantwortlichen Faktoren zum großen Teil bekannt sind, konnten die Forscher dieses Wissen nutzen und die Zellen in die eine oder andere Richtung schicken: In der Kulturschale wurden nun die beiden Stammzelllinien mit einigen dieser Entwicklungfaktoren (eine wichtige Rolle spielen unter anderem verschiedene „wnt“-Proteine) behandelt (Abb. 1).
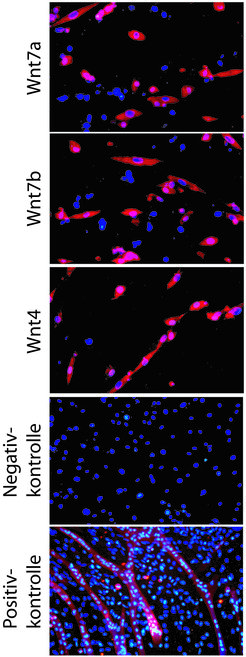
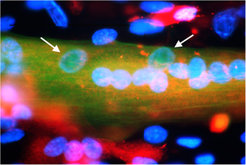
Alternativ wurden andere im Embryo ablaufende Mechanismen wie die epigenetische Reprogrammierung – hier handelt es sich um eine dauerhafte Modifikation der Gene ohne Veränderung der primären Basenfolge – imitiert. Tatsächlich zeigten die Stammzellen daraufhin eine Vielzahl Muskelzell-spezifischer Marker (u. a. waren die Gene Myf5, MyoD, Pax7, Myogenin und MRF4 aktiv), was einen Hinweis darauf gab, dass eine Entwicklung in Richtung Muskelzelle stattgefunden hatte. Zudem wurden auch für Muskelzellen wichtige Strukturproteine gebildet. Zusätzlich bedienten die Wissenschaftler sich eines besonderen Kunstgriffs, um die Daten abzusichern. So wurden die Zellen mit einem fremden Gen beladen, das für einen grünen Fluoreszenzfarbstoff codiert. Gleichzeitig wurde sichergestellt, dass dieser grüne Farbstoff nur dann gebildet wurde, wenn die Zelle auch die schwere Kette des Muskelproteins Myosin herstellt. Die Tatsache, dass die meisten Zellen nach einer gewissen Zeit unter UV-Licht grün leuchteten, war somit ein weiterer Beleg für die Anwesenheit des Muskelproteins. Außerdem konnte noch ein für Skelettmuskelzellen typischer Vorgang nachgewiesen werden, nämlich die Fusion von Einzelzellen (Abb. 2 und 3). Kultivierte man die aus den Stammzellen hervorgegangenen Zellen zusammen mit voll entwickelten Muskelzellen, konnte häufig das Verschmelzen von Zellen beider Abstammung beobachtet werden.

Auf halben Weg stehengeblieben?
Obwohl es durch die Behandlung der Stammzellen mit den Entwicklungsfaktoren gelang, eine ganze Reihe von Genen zu aktivieren, die für Herz- oder Skelettmuskelzellen typisch sind, sind letztendlich einige Einschränkungen zu machen. Es mangelte den Zellen nämlich am Ende noch immer an einigen wichtigen funktionellen und morphologischen Eigenschaften, die eigentlich für Muskelzellen charakteristisch wären. So zeigten sie beispielsweise keine Kontraktionsaktivität, was natürlich für Muskelzellen beiden Typs entscheidend wäre. Hier gilt es nun, die Frage nach dem Warum zu klären. Denkbar wäre, dass der Cocktail der Entwicklungsfaktoren nicht komplett war, sodass die Zellen den letzten Differenzierungsschritt nicht machen konnten. Denkbar wäre aber auch, dass adulte Stammzellen letztendlich gar nicht das Potenzial besitzen, komplette und funktionelle Muskelzellen zu werden. Ein Mechanismus, wie diese Zellen dennoch an der Regeneration der Muskulatur beteiligt sein könnten, kann man aus einem weiteren Experiment ableiten: Wurden Stamm- und Muskelzelle zwar in einem Gefäß, darin aber räumlich getrennt kultiviert, sodass alle wichtigen Signalmoleküle aus den Muskelzellen freien Zugang zu den Stammzellen hatten, blieb eine Differenzierung der Stammzellen in Muskelzellen aus. Als man hingegen die räumliche Trennung aufhob, konnte die Fusion von Stammzellen und Muskelzellen beobachten werden.
Differenzierung in alle Richtungen möglich
Für die Wissenschaftler war weiterhin die Frage interessant, ob die beiden Stammzelllinien auch ein Potenzial zur Differenzierung in andere spezifische Gewebszellen besitzen. Nach gleichem Schema wie bei der muskelspezifischen Differenzierung wurden die Zellen nun mit anderen Faktoren behandelt. Gab man Faktoren zu den Zellen, die in der Embryonalentwicklung an der Entwicklung von Nervenzellen beteiligt sind, zeigten sich in den ehemaligen Stammzellen Nerven-spezifische Marker. Nach der Behandlung mit Faktoren für die Knochenbildung wurden charakteristische Marker für Knochenzellen gefunden. Außerdem induzierte die Behandlung mit einem Leberzellen-Wachstumsfaktor die Expression von Albumin und SEK-1, ein Hinweis auf Leberzellen. Aus diesen Versuchen konnte abgeleitet werden, dass es sich bei den kultivierten Stammzellen um Zellen handelt, die einen geringen Differenzierungsgrad aufweisen und eine ausgeprägte Fähigkeit besitzen, sich in verschiedene gewebsspezifische Zellen zu entwickeln.
II. Können aus embryonalen Stammzellen entwickelte Zellen oder adulte Muskelstammzellen ein Infarkt-geschädigtes Herz heilen?
Gegenwärtig wird intensiv die Frage diskutiert, inwieweit Stammzellen zur Regeneration der Herzmuskulatur nach einem Infarkt beitragen. Zwar gibt es einige Forschergruppen, die berichten, dass verschiedene Stammzellpopulationen nach einem solchen Myokardinfarkt in der Herzwand zu finden seien und zudem die Funktion von Herzmuskelzellen oder Zellen der Blutgefäßwand übernähmen; die Studien sind allerdings umstritten. Allein ein Blick auf die gesundheitliche Entwicklung von Infarktpatienten zeigt, dass derlei Prozesse in der Regel zumindest nicht allzu effektiv sein können. Im Gegensatz dazu steht die Frage, inwieweit man aus Stammzellen gezüchtete Herzzellen therapeutisch nutzen kann, um zerstörtes Myokard (Herzmuskel) zu regenerieren. Zu dieser Fragestellung konnte das Team in Bad Nauheim einige interessante Daten gewinnen. Ihr Experiment bestand darin, Stammzellen aus der Skelettmuskulatur oder alternativ Herzmuskelzellen, die aus embryonalen Stammzellen herangezogen worden waren, in das Myokard von Mäusen zu injizieren. Bei diesen Tieren war zuvor durch den Verschluss eines Herzkranzgefäßes experimentell ein Infarkt ausgelöst worden. Mittels moderner Verfahren, zu dem die Magnetresonanztomographie gehört (hier steht ein Gerät zur Verfügung, das speziell für Untersuchungen an Kleintieren entwickelt wurde), konnte die Herzfunktion nach Auslösung des Myokardinfarkts untersucht werden (Abb. 4). Tatsächlich stellten sie fest, dass die Injektion der beiden Zelltypen in das geschädigte Gewebe langfristig zu einer verbesserten Pumpleistung des Herzens führte. Zudem zeigten histologische Untersuchungen vier Wochen nach Versuchsbeginn, dass bei den mit den Zellen behandelten Mäusen die Dimension des Infarktgebietes kleiner ausfiel, ebenfalls ein Hinweis auf einen positiven Effekt der Zellen. Entsprechend war bei diesen Mäusen auch weniger Narbengewebe zu finden, das als Folge des Infarkts gebildet wird. Jedoch fanden die Forscher in den Herzen der so behandelten Mäuse zu diesem Zeitpunkt keine Zelle mehr im Myokard, die aus den ursprünglich injizierten Zellen hervorgegangen war. Stattdessen konnten sie allerdings zeigen, dass die Stammzellen in der Lage waren, verschiedene wachstumsfördernde Substanzen abzugeben. Dies bedeutet demnach, dass der positive Effekt der injizierten Stammzellen nicht primär auf den Ersatz zerstörter Herzzellen zurückzuführen ist. Vielmehr werden Faktoren freigesetzt, die anschließend einen Regenerationsprozess fördern, der auf den ursprünglichen Herzmuskelzellen basiert.




