Von der Lungenentwicklung zur Lungenregeneration
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Herz- und Lungenforschung - W. G. Kerckhoff-Institut
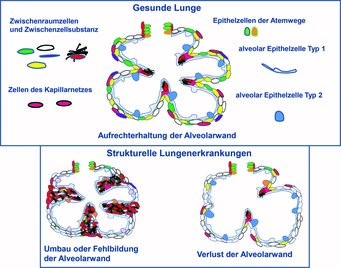
Schädigung der Alveolen bei strukturellen Lungenerkrankungen
Der Gasaustausch, die Aufnahme von Sauerstoff in das Blut und die Abgabe von Kohlendioxid in die Ausatemluft ist die zentrale Funktion der Lunge. Dieser Prozess findet in den Lungenbläschen, den sogenannten Alveolen, statt. Voraussetzung hierfür ist eine ungestörte Bildung sowie Aufrechterhaltung ihrer Struktur. Die Wände der Alveolen bestehen aus einem Blutgefäßsystem (Kapillarnetz), das in ein Zellsystem aus Zwischenraumzellen (interstitiellen Zellen) und Zwischenzellsubstanz (extrazelluläre Matrix) eingebettet ist. Auf der Innenseite sind die Alveolarwände mit Epithelzellen ausgekleidet. Quaderartige alveoläre Typ 2-Zellen bilden eine Substanz (surfactant), welche die Oberflächenspannung der Alveolen herabsetzt und sie dadurch vor dem Zusammenfallen schützt. Flache alveoläre Typ 1-Zellen erstrecken sich über mehrere Alveolen und verbinden sie miteinander. Sie tragen zum Flüssigkeitstransport bei und ermöglichen den Gasaustausch mit den Kapillaren (Abb. 1, [1]).

Strukturelle Lungenerkrankungen der neugeborenen Lunge (z. B. Bronchopulmonale Dysplasie, BPD) sowie der erwachsenen Lunge (z. B. chronisch obstruktive Lungenerkrankung, COPD, und pulmonale Fibrose) können durch eine Fehlbildung, eine Zerstörung oder einen Umbau der Alveolen (Abb. 1) gekennzeichnet sein. Die möglicherweise zugrunde liegenden Mechanismen sind derzeit nicht hinreichend aufgeklärt. Es scheint jedoch, dass die für die Bildung und Erhaltung der Alveole notwendigen Wechselwirkungen zwischen den Zellen sowie die Bildung der extrazellulären Matrix gestört sind [2]. Während der Lungenentwicklung tragen vielfältige Prozesse zur Bildung der Alveole (Alveologenese) bei. Ein besseres Verständnis der Zellfunktionen und Wechselwirkungen zwischen den Zellen während der Alveologenese kann dazu beitragen, Zellen und Moleküle zu identifizieren, welche beeinflusst werden können, um das Wachstum von Alveolen in der erkrankten Lunge (Lungenregeneration) anzuregen. Gegenstand derzeitiger Forschungsprojekte ist die Analyse einzelner Zellfunktionen, der Wechselwirkungen zwischen den Zellen und deren molekularen Profile, sowie ihrer Regulation im Rahmen der Alveologenese.
Die Alveologenese
Das derzeitige Wissen um die Alveologenese wurde überwiegend durch die Analyse der Lungenentwicklung in Mäusen und Ratten gewonnen [3]. Die Bildung der Alveolen findet bei Mäusen und Ratten überwiegend nach der Geburt statt. Beim Menschen sind dagegen zum Zeitpunkt der Geburt bereits ausgereifte Alveolen vorhanden. Der Prozess der Alveologenese beim Menschen weist dennoch viele Parallelen zur Alveologenese der Maus auf, so dass letztere als Modell der Alveologenese anerkannt ist. Die Lunge befindet sich zum Zeitpunkt der Geburt im sogenannten sakulären Stadium: es existieren noch unreife Alveolen (alveoläre Luftsäcke), die von ausgereiften alveolären Epithelzellen Typ 1 und Typ 2 ausgekleidet sind. Die dreidimensionale Struktur ähnelt einem Ball. Das zur Geburt beginnende alveoläre Stadium der Lungenentwicklung, die Alveologenese, ist von der Existenz und möglichen Funktion einer Gruppe interstitieller Zellen, der alveolären Fibroblasten sowie von der Bildung und Vernetzung der extrazellulären Matrix geprägt [4].

Abb. 2: Schematische Darstellung der Alveologenese anhand zweidimensionaler Schnittbilder durch die sich entwickelnde unreife Alveole (links) und die reife Alveole (rechts). Die unreife Alveole würde in ihrer dreidimensionalen Struktur der Gestalt eines Balles ähneln. Sekundäre Alveolarwände entwickeln sich aus den primären Alveolarwänden. In diesen befinden sich Subtypen der Fibroblasten wie Myofibroblasten, Lipofibroblasten und PDGFRa-positive Zellen. Zwischenzellsubstanz wie Elastin und Myofibroblasten befinden sich in den sich bildenden Falten der sekundären Alveolarwände.
Die Wand der unreifen Alveole wird als primäre Alveolarwand bezeichnet. Durch Einfalten der primären Alveolarwand zum Inneren der unreifen Alveole entstehen sogenannte sekundäre Alveolarwände (Abb. 2). Hierbei ist nicht geklärt, ob die sekundären Wände „nach innen wachsen“ oder durch Ausdehnung der nicht eingefalteten Bereiche der primären Alveolarwand entstehen. Allerdings wurde bereits die Existenz von Myofibroblasten - also Fibroblasten, welche kontraktile Elemente und extrazelluläre Matrix (z. B. Elastin) bilden - in den neu entstehenden sekundären Alveolarwänden gezeigt [4, 5]. Die Entfernung eines Wachstumsfaktors, des Platelet-derived growth factor A (PDGFA) in der Maus führte zu einem kompletten Abbruch der Bildung der sekundären Alveolarwände mit resultierenden unreifen Alveolen und fehlender Wandbildung [6]. Zudem zeigte sich eine Abwesenheit von Myofibroblasten und Elastin. Eine dauerhafte farbliche Markierung von Zellen, welche den Rezeptor des PDGFA, den Platelet-derived growth factor receptor a (PDGFRa) bilden, zeigte, dass diese Zellen als Vorläuferzellen von Myofibroblasten und einer weiteren Fibroblastenart, den Lipofibroblasten, dienen können [7]. Die aus den PDGFRa-bildenden Zellen entstandenen Lipofibroblasten waren in den primären Alvolarwänden und an der Basis der sich entwickelnden sekundären Alveolarwände lokalisiert (Abb. 2).
Lipofibroblasten der Lunge sind Zellen, die Fetttröpfchen enthalten und bestimme Proteine des Fettstoffwechsels bilden. Während der Alveologenese sind sie zahlreich in der Lunge vorhanden. Sie unterstützen die alveoläre Produktion von Surfactant und ihre Aktivierung schützt die Lunge in einem Mausmodell der Bronchopulmonalen Dysplasie. Die Existenz von Lipofibroblasten in der menschlichen Lunge wird kontrovers diskutiert [8]. Mechanische Kräfte wie Dehnung und Entspannung scheinen sowohl die Funktion der Myofibroblasten als auch der Lipofibroblasten durch die Bildung bestimmter Faktoren zu beeinflussen. Aktuelle Daten zeigen die Beteiligung von Lipofibroblasten an der Entwicklung der Lungenfibrose in einem Mausmodell [9]. Ein präzise kontrolliertes Gleichgewicht zwischen kontraktilen Myofibroblasten, welche strukturbildende extrazelluläre Matrix bilden, sowie metabolisch aktiven Lipofibroblasten, welche die Funktion der alveolären Epithelzellen unterstützen, scheint für die Alveologenese von zentraler Bedeutung zu sein. Daher ist die Erweiterung des Wissens um den Ursprung, die Differenzierung, die Wechselwirkung zwischen den Zellen sowie die molekularen Muster von Myofibroblasten, Lipofibroblasten und deren Vorläuferzellen weiterer Gegenstand aktueller Forschungsprojekte.
Kompensatorisches Lungenwachstum: Die Neo-Alveologenese in der erwachsenen Lunge

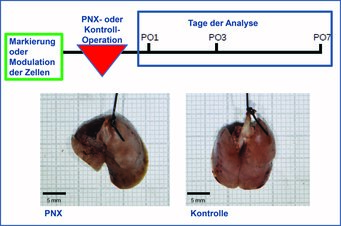
Abb. 3: Experimenteller Aufbau des PNX-Modells. Zellen werden in der erwachsenen Maus vor der Pneumonektomie markiert oder moduliert. An den ersten sieben Tagen nach der Operation (postoperative day, PO) werden die Lungen auf Strukturveränderungen, Lokalisation der markierten Zellen sowie molekularbiologisch untersucht. Wie sich zeigte, ist die erwachsene Lunge nach einer Entnahme eines linken Teils zu kompensatorischem Lungenwachstum befähigt (Neo-Alveolarisierung). Sieben Tage nach der Entnahme des linken Teils erreicht die verbleibende Lunge (linkes Bild) die Ausmaße der Kontrolllunge (rechtes Bild).
Die Bildung von Alveolen findet nicht nur während der Lungenentwicklung (Alveologenese) statt, sondern wurde auch in der erwachsenen Lunge nach einer Pneumonektomie (Herausnahme eines Teils der Lunge) im Menschen, in der Maus und weiteren Spezies beobachtet. Die Pneumonektomie (PNX) in der Maus ist daher ein gutes Modell, um die zellulären und molekularen Prozesse der Neo-Alveologenese zu analysieren. Bereits 21 Tage nach der PNX zeigte sich das Lungenvolumen der verbleibenden Lunge in einer operierten Maus unverändert zu dem Lungenvolumen einer nicht operierten Maus [10]. Die zugrunde liegenden Prozesse der Neo-Alveologenese sind derzeit nicht hinreichend verstanden.
Im Mausmodell der PNX wurden mechanische Kräfte, die Umorganisation extrazellulärer Matrix sowie die Beteiligung verschiedener Signalwege und einer vermehrten Zellteilung (Proliferation) beschrieben [2, 10]. Eine Analyse des Volumenzuwachses der einzelnen Lungenanteile zeigte die größte Volumenzunahme im herznahen Lungenlappen [10]. Daher werden strukturelle und molekularbiologische Analysen überwiegend im herznahen Lappen durchgeführt. Gegenstand derzeitiger Forschungsprojekte ist die detaillierte Analyse der Lokalisation, der Funktion, die zellulären Wechselwirkungen sowie die molekularen Muster und deren Regulation der Fibroblasten zu verschiedenen Zeitpunkten während der Neo-Alveologenese (Abb. 3). Dafür stehen transgene Mausmodelle zur Markierung und Modulation von Zellen sowie molekularbiologische Techniken zur Verfügung.
Die Lungenregeneration: ein Ausblick
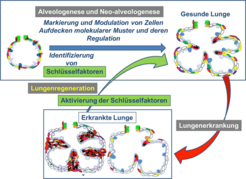
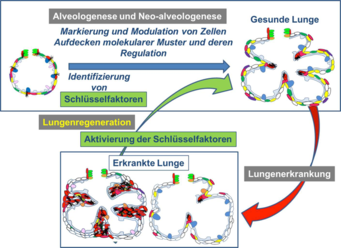
Abb. 4: Theorie der Lungenregeneration: Durch Analyse der Alveologenese und Neo-Alveologenese können Schlüsselfaktoren identifiziert werden. Diese Schlüsselfaktoren werden in Organproben von Mensch und Maus weiter funktionell analysiert. In Krankheitsmodellen der Maus soll dann die Aktivierung/Modulation der Schlüsselfaktoren ausgelöst werden, um die Regeneration des erkrankten Lungengewebes zu erzielen. Ziel ist die Entwicklung neuartiger Therapieansätze für Erkrankungen des Menschen.
In aktuellen Forschungsprojekten wurden Moleküle identifiziert, die an der Bildung von neuen Alveolen beteiligt sind. Bisher ist das Wissen jedoch nicht ausreichend, um die Bildung der Alveolen in der erkrankten Lunge anzuregen. Ziel der Forschungsprojekte ist es daher, durch dauerhafte farbliche Markierung oder Modulation der relevanten Zellen ein besseres Verständnis der Prozesse der Alveologenese und Neo-Alveologenese zu erlangen (Abb. 4). So können molekulare Muster und deren Regulation, die beteiligten Stoffwechselwege sowie die Funktionen der dabei identifizierten Schlüsselfaktoren in der Maus analysiert werden. In Krankheitsmodellen der Maus (BPD, COPD, Fibrose) können diese Schlüsselfaktoren und ihre Rolle für die Lungenregeneration analysiert werden, um neue Therapieansätze für den Menschen zu finden.
Literaturhinweise
Cell stem cell 15, 123-138 (2014)
American journal of physiology lung cellular and molecular physiology 308, L1145-L1158 (2015)
Development 124, 3943-3953 (1997)